Elektrolys-oxidering av järn
Jag såg nyligen ett avsnitt av Mytjägarna (episode 26, Salza escape). Där provade dom bla om man kunde bryta sig ut ur ett fängelse med Salza-sås. Det snabbaste sättet som provades var att använda elektrolys för att äta sig igenom ett fängelsegaller. Jag har funderat på hur bra elektrolys är på att äta stål tidigare, och kunde inte låta bli att räkna lite.
Antaganden/Uppställning:
- Staven oxideras sönder i processen, dvs lämnar ifrån sig elektroner. --> Staven skall koplas till pluspolen.
- För att inte avverka mer volym än nödvändigt, är staven bara delvis i kontakt med elektrolyten.
- Antar att det behövs en elektron för varje järnatom som oxiderar. (kan ev vara två)
- Ström I Ampere genom kretsen, tid t för oxidationen, volymen V ska oxideras.
- Konstanter: densitet p=7,874 g/cm3; atomvikt 58,847u --> mFe=9,2736E-23 gram; Elektronladdning e=1,6022E-19.
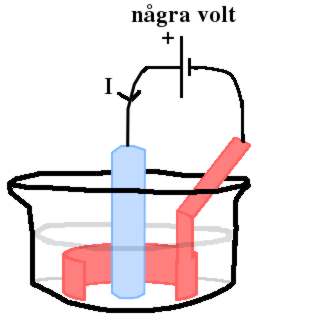
Järnstav i mitten av grund bägare. Järnstaven kopplad till pluspol. Till minuspolen är en ringformad elektrod ansluten.
Beräkningar:
antal elektroner som passerat = I*t/e
Järnmolekyler att oxidera = V*p/(mFe)
==> t=V*p*e/(mFe*I) tid i sekunder för oxidation.
Vill man t.ex oxidera bort 0,5 cm3 blir tiden (använd gram och cm3 på alla ställen)
t=0.5*7,874*1,6022E-19/(9,2736E-23*I)=6802/I sekunder = 1,9/I timmar
En ström på 100mA skulle alltså ta bort den efterfrågade volymen av staven på storleksordningen 19 timmar. Med strömmen 1A skulle det bara behövas 1,9 timmar. Om det skulle behövas två elektroner för att oxidera järn blir de uppgivna tiderna de dubbla. Kapaciteten som behövs av batteriet, 1,9AH, finns det R6-batterier som kan ge. Sen behöver man kanske öka spänningen något för att strömmen ska bli så stor att det inte tar allför lång tid (seriekoppla några batterier). På grund av elektronegativitet eller något sådant kanske man behöver ha en viss minimispänning (storleksordning någon volt) för att processen ska fungera, men jag tror inte att det ska behövas för oxidation av järn.
Bilder på upplösning av aluminium:
Den plussformade elektroden är kopplad till plus, och den minusformade till minus (pedagogiskt :) Bilden visar vad som sker med pluspolen, hur aluminiumet där oxideras sönder, samtidigt som minuspolen klarar sig utan skador. För att snabba upp processen lite så blandade jag i vanligt salt i vattnet. Saltet ökar strömmen och därmed oxidationen av den positiva elektroden. Den positiva elektroden kommer dock inte att oxideras om det är lättare att oxidera vätskan den är nedsänkt i än att oxidera själva elektroden. Men man får oftast fenomenet att den positiva elektroden oxideras. Ibland kan jonerna från pluspolen reduceras när de kommer fram till minuspolen, och det utnyttjas i en del kemiska processer (t.ex. plättering) .
Har också en ful animation av förloppet animation.gif (601,5 kb)
Du ansvarar själv för risken att skada dig själv/andra/saker/datorer/eller annat!
